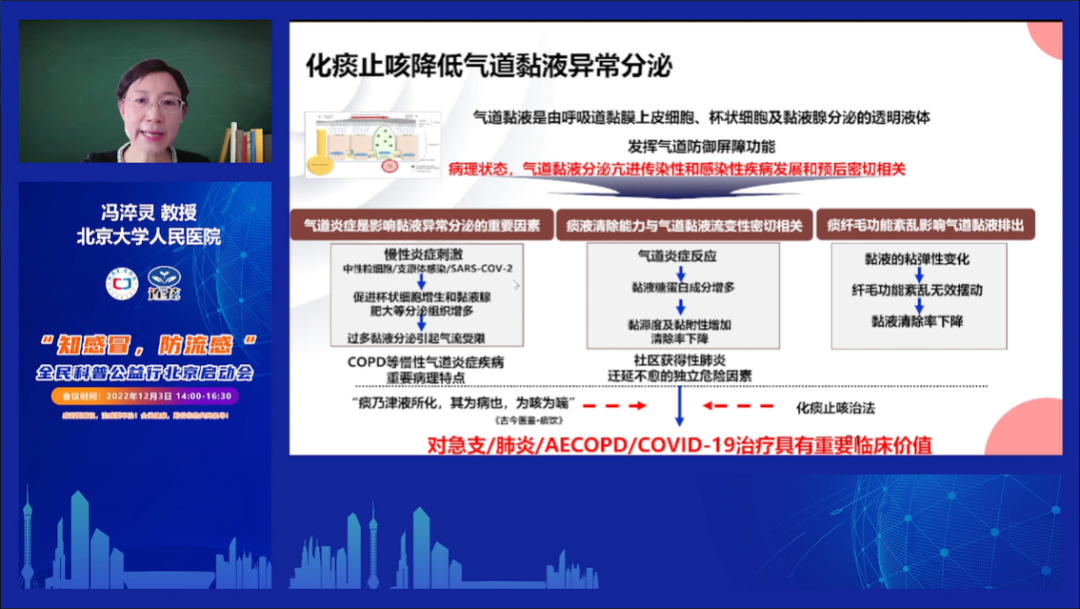
针对HER2的靶向治疗,是目前最成功的靶向治疗之一,标志性的单克隆抗体类靶向药曲妥珠单抗,已经广泛应用于胃癌和乳腺癌的治疗,且显著延长了乳腺癌和胃癌患者的生存时间[1]。
HER2作为一种癌基因,在胆管癌、结直肠癌、膀胱癌、唾液腺癌、非小细胞肺癌中也存在基因过度扩增或者蛋白过度表达的现象[2],然而单抗类靶向药对乳腺癌和胃癌以外的肿瘤,治疗效果却差强人意[3],因此还需要更多针对HER2靶点的创新药物,当前各种新药也在不断涌现。
近日,由德克萨斯大学安德森癌症中心Funda Meric-Bernstam教授领衔的研究团队,在The Lancet Oncology发表了一项重要研究成果。该研究发现,HER2双特异性抗体Zanidatamab在临床治疗中具有良好的耐受性,且治疗HER2过表达或过度扩增的晚期肿瘤(以胆管癌和结直肠癌为主)患者,客观缓解率可达37%[4],提示Zanidatamab在胃癌和乳腺癌以外肿瘤的治疗中初步疗效良好。
 (资料图片仅供参考)
(资料图片仅供参考)
图1. 文章封面截图
Zanidatamab靶向HER2的细胞外结构域和二聚化结构域,可同时结合两个非重叠的HER2表位ECD4(曲妥珠单抗靶向域)和ECD2(帕妥珠单抗靶向域),从而阻断双重HER2信号并消除细胞表面的HER2蛋白[5]。此外,Zanidatamab可抑制生长因子依赖性的肿瘤细胞增殖,还可激活抗体依赖性的细胞毒性、细胞吞噬作用和补体依赖性的细胞毒性[6]。
临床前研究显示,Zanidatamab在多种HER2过表达或过度扩增的肿瘤中,具有很强的抗肿瘤活性[5],或可成功应用于胆管癌、结直肠癌等癌症的临床治疗。
本次公布结果的临床研究共分为两个阶段,即剂量递增试验和扩展试验,分别用于确定Zanidatamab的最大耐受剂量和最佳治疗剂量,并观察Zanidatamab的初步治疗效果(图2)。
在第一阶段,共计46例患者(以胃癌和乳腺癌患者为主)被纳入,并分为7个剂量组,最大剂量为30mg/kg(图2)。在所有剂量组中,最常见的不良反应为腹泻和输液反应,发生率分别为52%和43%;仅7%的患者出现了3级不良反应,主要为关节疼痛、疲劳和低磷血症、食欲下降和高血压;在46例患者中,无一例出现严重不良反应。由此可见,Zanidatamab具有较高的临床耐受性。
图2. 剂量递增阶段研究设计
基于第一阶段,研究人员确定了最佳治疗剂量为20mg/kg(每两周一次),为进一步确定此剂量下Zanidatamab的安全性并初步研究其治疗效果,研究人员纳入了86例HER2过表达的晚期癌症患者(22例胆管癌或胆囊癌,28例结直肠癌和36例非小细胞肺癌、卵巢癌等其他癌症)(图3)。
图3. 扩增阶段研究设计
在第二阶段,腹泻仍然是患者最常见的不良反应,且大部分不良反应均为1-2级,3级不良反应仅一例(腹泻),因此按20mg/kg每两周一次给药的Zanidatamab,在临床治疗中具有很好的安全性,但其对胆管癌、结直肠癌等实体瘤的治疗效果尚未可知。
在这86例患者中,共计83例患者可评估疾病缓解情况:胆管癌、结直肠癌和其他癌症的客观缓解率(ORR)分别为38%、38%和36%,总体ORR为37%;胆管癌的中位缓解持续时间(DoR)为8.5个月,结直肠癌为5.6个月,其他癌症为9.7个月,部分患者缓解持续时间大于一年(图4)。
图4. Zanidatamab对不同癌症的持续缓解时间
此外,所有患者的中位无进展生存期为5.4个月(95% CI: 3.7-7.3),其中胆管癌为3.5个月(95% CI: 1.8-6.7),结直肠癌为6.8个月(95% CI: 3.5-7.8),其他癌症为5.5个月(95% CI: 3.6-8.3)。
在83例可评估缓解情况的患者中,有63例(76%)患者肿瘤缩小(图5),其中14例曾接受过曲妥珠单抗或帕妥珠单抗的治疗,胆管癌中1例,结直肠癌中3例,其他肿瘤中10例(图6)。由此可见,Zanidatamab不仅适用于除胃癌及乳腺癌以外的癌症,而且有望用于经HER2单抗治疗后的患者。
图5. Zanidatamab对不同肿瘤病灶体积的缩减效果
图6. Zanidatamab对其他癌症中接受过HER2靶向治疗患者的治疗效果(K:恩美曲妥珠单抗;T:曲妥珠单抗;P:帕妥珠单抗;L:拉帕替尼)
总之,这项研究发现HER2双特异性抗体Zanidatamab对乳腺癌和胃癌以外的癌症也具有很好的治疗效果,且安全性较高,而据刚刚公布的消息,Zanidatamab已取得治疗HER2过表达或过度扩增胆管癌的临床2b期关键试验成功,治疗的客观缓解率达到41.9%,且中位DoR超过一年,相关适应证有望基于该研究结果获批。
目前国内也同期开展了Zanidatamab治疗晚期HER2阳性乳腺癌或胃/胃食管连接处腺癌的III期临床试验(CTR20210237),有望为Zanidatamab的临床应用提供更为充分的证据,也期待这项研究能够传来新的好消息。
参考文献:
[1] Duranti S, Fabi A, Filetti M, et al. Breast Cancer Drug Approvals Issued by EMA: A Review of Clinical Trials. Cancers (Basel). 2021 Oct 16;13(20):5198. doi: 10.3390/cancers13205198.
[2] Yan M, Schwaederle M, Arguello D, et al. HER2 expression status in diverse cancers: review of results from 37,992 patients. Cancer Metastasis Rev. 2015 Mar;34(1):157-64. doi: 10.1007/s10555-015-9552-6.
[3] Siena S, Di Bartolomeo M, Raghav K,et al. Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial. Lancet Oncol. 2021 Jun;22(6):779-789. doi: 10.1016/S1470-2045(21)00086-3.
[4] Meric-Bernstam F, Beeram M, Hamilton E, et al. Zanidatamab, a novel bispecific antibody, for the treatment of locally advanced or metastatic HER2-expressing or HER2-amplified cancers: a phase 1, dose-escalation and expansion study. Lancet Oncol. 2022 Nov 15:S1470-2045(22)00621-0. doi: 10.1016/S1470-2045(22)00621-0.
[5] Dixit S, Abraham L, Weiser N, et al. Super-resolution imaging studies of zanidatamab: providing insights into its bispecific mode of action. American Association of Cancer Research, 2021; Virtual: AACR; Cancer Research; 2021 (abstr 1032).
[6] Weisser N, Wickman G, Abraham L, et al. The bispecific antibody zanidatamab"s (ZW25"s) unique mechanisms of action and durable anti-tumor activity in HER2-expressing cancers. Proceedings of the American Association for Cancer Research Annual Meeting; 2021 Apr 10-15 and May 17-21; Virtual: AACR; Cancer Res 2021 (abstr 1005).